resumen nº1
leyes que rigen la estequiometría
1ª Ley de la Estequiometría o Ley de conservación de masa de Lavoisier.
“En toda reacción química las cantidades en masa de los reactivos son iguales a las cantidades en masa de lo productos”.
2ª Ley de las proporciones constantes de Proust.
“Cuando dos o más elementos se unen para formar un mismo compuesto, siempre lo hacen en una relación ponderal constante”.
3ª Ley de las proporciones múltiples de Dalton.
“Cuando dos o más elementos se unen para formar una serie de compuestos, si el peso de uno de ellos permanece constante y el otro varía, las cantidades de este son múltiplos enteros de la menor de ellas”.
4ª Ley de las Proporciones Recíprocas o Equivalentes de Richter - Wenztel.
“Cuando dos elementos se combinan separadamente con un peso fijo de un tercer elemento, los pesos relativos de aquellos son los mismos que sí se combinan entre sí“.
resumen nº2
molaridad
Definición
La concentración molar o molaridad c (o M) se define como la cantidad de soluto por unidad de volumen de disolución, o por unidad de volumen disponible de las especies:2
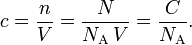
Aquí, n es la cantidad de soluto en moles,1 N es el número de moléculas presentes en el volumen V(en litros), la relación N/V es la densidad numérica C, y NA es el número de Avogadro, aproximadamente 6,022 . 1023 mol−1.O más sencillamente: 1 molar = 1 M = 1 mol/litro.
Las unidades SI para la concentración molar son mol/m3. Sin embargo, la mayor parte de la literatura química utiliza tradicionalmente el mol/dm3, o mol . dm-3, que es lo mismo que mol/L. Esta unidad tradicional se expresa a menudo por la M (mayúscula) (pronunciada molar), precedida a veces por unprefijo SI, como en:
- mol/m3 = 10-3 mol/dm3 = 10-3 mol/L = 10-3 M = 1 mM .
Los términos "milimolar" y "micromolar" se refieren a mM y μM (10-3 mol/L y 10-6 mol/L), respectivamente.
| Nombre |
Abreviatura |
Concentración |
| Milimolar |
mM |
10-3 molar |
| Micromolar |
μM |
10-6 molar |
| Nanomolar |
nM |
10-9 molar |
| Picomolar |
pM |
10-12 molar |
| Femtomolar |
fM |
10-15 molar |
| Attomolar |
aM |
10-18 molar |
| Zeptomolar |
zM |
10-21 molar |
| Yoctomolar |
yM3 |
10-24 molar
(1 molécula por 1.6 litros) |
La mayor parte de las proteinas están presentes en las bacterias como E. coli en unas 60 copias o menos. El volumen de una bacteria es 10- 15 L, lo que nos da una concentración c = N/(NA . V)}} = 10- 7 M = 100 nM. (Aquí, nM es "nanomolar", es decir, 10- 9 moles por litro).
Consideremos la preparación de 100 ml de una solución 2 M de NaCl en agua. Dado que la masa molar del NaCl es 58 g/mol, la masa total necesaria es 2*(58 g)*(100 mL)/(1000 mL) = 11,6 g, disueltos en ~80 ml de agua, y posteriormente añadiendo agua hasta que el volumen alcanza 100 mL.
Por el contrario, consideremos 11,6 g de NaCl disueltos en 100 mL de agua. La densidad del agua es de alrededor de 1 g/mL, lo que significa que la concentración final de [NaCl]] podría ser (expresada en %) de (11,6 g)/(11,6 g + 100 g) = 10,4 %. La densidad de esta disolución es 1,07 g/mL, y su volumen será (11,6 g + 100 g)/(1,07 g/mL) = 104,3 mL. La concentración molar del NaCl en la solución será entonces de (11,6 g)/(58 g/mol)/(104,3 mL)*1000 = 1,92 M.
resumen nº3
reactivo limitante
El reactivo limitante es el reactivo que en una reacción química determina, o limita, la cantidad de producto formado.
Cuando una ecuación está balanceada, la estequiometría se emplea para saber los moles de un producto obtenidos a partir de un número conocido de moles de un reactivo. La relación de moles entre reactivo y producto se obtiene de la ecuación balanceada.
Generalmente cuando se efectúa una reacción química los reactivos no se encuentran en cantidades estequiométricas exactas, es decir, en las proporciones que indica su ecuación balanceada. En consecuencia, algunos reactivos se consumen totalmente, mientras que otros son recuperados al finalizar la reacción. El reactivo que se consume en primer lugar es llamado reactivo limitante, ya que la cantidad de éste determina la cantidad total de producto formado. Cuando este reactivo se consume, la reacción se detiene. El o los reactivos que se consumen parcialmente son los reactivos en exceso.
La cantidad de producto que se obtiene cuando reacciona todo el reactivo limitante se denominarendimiento teórico de la reacción.
El concepto de reactivo limitante permite a los químicos asegurarse de que un reactivo, el más costoso, sea completamente consumido en el transcurso de una reacción, aprovechándose así al máximo.
Método 1
Este método se basa en la comparación de la proporción de cantidades de reactivo con la relación estequiométrica. Así, dada la ecuación general:

Siendo X e Y reactivos, Z productos y a, b y c, sus respectivos coeficientes estequiométricos.
Si  <
<  entonces X es el reactivo limitante.
entonces X es el reactivo limitante.
Si  >
>  entonces Y es el reactivo limitante.
entonces Y es el reactivo limitante.
Ejemplo
]
La ecuación balanceada para la oxidación del monóxido de carbono a dióxido de carbono es la siguiente:

Si se tienen 4 moles de monóxido de carbono y tres moles de oxígeno, ¿cuál es el reactivo limitante?
Aplicando el procedimiento anterior tenemos que
 <
<  , por lo tanto CO es el reactivo limitante. En efecto, cuatro moles de CO sólo necesitan dos moles de O2 para reaccionar, por lo que un mol de O2 quedará como exceso una vez finalizada la reacción.
, por lo tanto CO es el reactivo limitante. En efecto, cuatro moles de CO sólo necesitan dos moles de O2 para reaccionar, por lo que un mol de O2 quedará como exceso una vez finalizada la reacción.
Mapas Conceptuales